12/10/2009
Antivirais e resistência: inibidores de sialidase
Com as falhas terapêuticas das adamantanas, surgiu o interesse no desenvolvimento de novas drogas contra o vírus da gripe. Surgiram daí os inibidores de neuraminidase oseltamivir e zanamivir, a primeira classe de drogas planejadas contra o Influenza. Aqui, o caminho tomado para a produção delas foi contrário ao da amantadina. Ao invés de se testar a droga e depois descobrir como ela funciona, identificaram um possível alvo e as fabricaram.
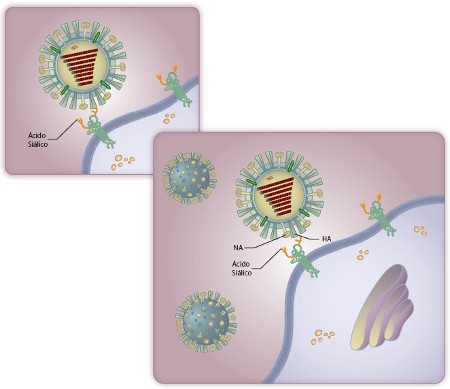
Vírus Influeza saindo da célula. Sua Hemaglutinina (HA) continua presa ao ácido siálico – acima. Até que a Neuraminidase (NA) desligue o ácido da célula – abaixo.
O alvo foi a Neuraminidase (NA), enzima que ajuda na liberação do vírus. Quando o Influenza recém formado brota da célula infectada, sua Hemaglutinina (HA) se liga ao ácido siálico de fora dela, pelo mesmo mecanismo que o vírus utilizou para entrar. Mas agora, ele não deve se ligar à célula e sim sair dela. A Neuraminidase reconhece estes ácidos siálicos e os cliva, liberando a o vírus.
O desenvolvimento do zanamivir e do oseltamivir tomou vantagem desta etapa. Ambas as drogas imitam o ácido siálico, mas não são quebradas. Desta forma são reconhecidos pela NA que se liga a eles e não conseguem atacar os ácidos da membrana. [1]
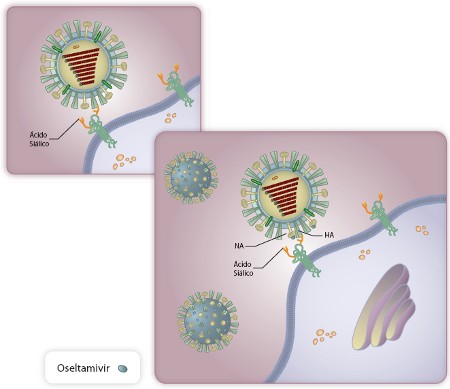
O oseltamivir se liga a Neuraminidase (NA) do Influenza e impede-a de clivar o ácido siálico. Assim, o vírus continua preso à célula após sair.
Fazer uso desta afinidade da Neuraminidase pelo ácido siálico traz algumas vantagens. A primeira dela é a especificidade, ambas as drogas são muito bem reconhecidas pela enzima viral, agindo tanto no Influenza A quanto no B, e são pouco reconhecidas por enzimas humanas, o que diminui as chances de efeitos colaterais. [2] Por fim, como elas imitam o substrato natural da enzima (molécula onde ela atua), a Neuraminidase perder a afinidade por elas implica em perder a afinidade pelo nosso ácido siálico. Assim, vírus com NA resistentes também são menos eficientes, pois se ligam menos à droga e ao substrato. [3]
Isso não quer dizer que não existam Neuraminidases resistentes. A mutação de resistência mais comum é a H274Y (ou H275Y, dependendo do tipo de NA usada como referência,) que significa o aminoácido histidina mutado para uma tirosina na posição 275. Ela muda a interação da Neuraminidase com o oseltamivir diminuindo a afinidade por ele. Entretanto, o zanamivir interage com outros pontos de NA e não é atingido por esta mutação, o que torna a NA com H274Y resistente ao oseltamivir e sensível ao zanamivir.[4]
Existem outras mutações de resistência, algumas inclusive diminuindo a susceptibilidade ao zanamivir [5], mas estas em geral comprometem bastante a viabilidade do vírus portador. Curiosamente, o Influenza A (H1N1) é suscetível ao oseltamivir e zanamivir, enquanto a linhagem de H1N1 que circulou entre fim de 2008 e começo de 2009 nos EUA era quase 100% resistente, devido à mutação H274Y. [6]
Tal conhecimento sobre as mutações de resistência nos permitem prever qual droga deve ou não ser usada. Antes mesmo de começarem o tratamento contra o Influenza A (H1N1), já se sabia que a mutação de resistência mais provável em sua Neuraminidase é a H274Y. Com isso, foi previsto que, caso ocorresse o surgimento de um vírus resistente ao oseltamivir, ele seria sensível ao zanamivir. [7]
E foi o que aconteceu, até o dia 02 de outubro foram encontrados 28 casos de resistência, todos com H274Y. E todos tratados com sucesso com zanamivir, que não costuma ser a primeira droga de escolha por ser inalável, via comprometida em uma gripe, enquanto o oseltamivir é tomado por via oral.
Mas ambas as drogas, adamantanas e inibidores de sialidase, não nos garantem conforto. No próximo post da série, perspectivas no desenvolvimento de novos antivirais.
Fontes:
[1] von Itzstein, M., Wu, W., Kok, G., Pegg, M., Dyason, J., Jin, B., Phan, T., Smythe, M., White, H., Oliver, S., Colman, P., Varghese, J., Ryan, D., Woods, J., Bethell, R., Hotham, V., Cameron, J., & Penn, C. (1993). Rational design of potent sialidase-based inhibitors of influenza virus replication Nature, 363 (6428), 418-423 DOI: 10.1038/363418a0
[2] Hata, K., Koseki, K., Yamaguchi, K., Moriya, S., Suzuki, Y., Yingsakmongkon, S., Hirai, G., Sodeoka, M., von Itzstein, M., & Miyagi, T. (2008). Limited Inhibitory Effects of Oseltamivir and Zanamivir on Human Sialidases Antimicrobial Agents and Chemotherapy, 52 (10), 3484-3491 DOI: 10.1128/AAC.00344-08
[3] De Clercq, E. (2006). Antiviral agents active against influenza A viruses Nature Reviews Drug Discovery, 5 (12), 1015-1025 DOI: 10.1038/nrd2175
[4] Collins, P., Haire, L., Lin, Y., Liu, J., Russell, R., Walker, P., Skehel, J., Martin, S., Hay, A., & Gamblin, S. (2008). Crystal structures of oseltamivir-resistant influenza virus neuraminidase mutants Nature, 453 (7199), 1258-1261 DOI: 10.1038/nature06956
[5] Hurt, A., Holien, J., Parker, M., Kelso, A., & Barr, I. (2009). Zanamivir-Resistant Influenza Viruses with a Novel Neuraminidase Mutation Journal of Virology, 83 (20), 10366-10373 DOI: 10.1128/JVI.01200-09
[6] . (2009). Emergence of a Novel Swine-Origin Influenza A (H1N1) Virus in Humans New England Journal of Medicine, 360 (25), 2605-2615 DOI: 10.1056/NEJMoa0903810
[7] Soundararajan, V., Tharakaraman, K., Raman, R., Raguram, S., Shriver, Z., Sasisekharan, V., & Sasisekharan, R. (2009). Extrapolating from sequence—the 2009 H1N1 ’swine’ influenza virus Nature Biotechnology, 27 (6), 510-513 DOI: 10.1038/nbt0609-510
4 Comentários » Postado em: Combate ao vírus, prevenção, resistência


Atila primeiramente gostaria de agradecer seus comentários a respeito de minhas ponderações referentes ao H1N1 (desculpa não te agradecer antes), porém coincidentemente resolvi (mesmo não sendo virologista) investigar a composição molecular do H1N1 no PUBMED. Existe grande similaridade principalmente ao encontrado em outras cepas de A/Solomon Islands/3/2006 (H1N1) (verificar simplesmente no BioEdit), acompanhado a isso encontrei a seguinte reportagem relacionada a imunidade cruzada:
“Pessoas idosas que contraíram ou se vacinaram contra a gripe sazonal podem ter uma imunidade produzida por células que as protege do vírus H1N1, responsável pela gripe suína, disseram pesquisadores nesta quarta-feira. Eles disseram que partes do H1N1 foram encontrados em cepas de vírus anteriores e que algumas pessoas com mais de 60 anos de idade, que já foram expostas a vírus similares, podem ter células capazes de protegê-las.
“Estas descobertas indicam que populações humanas podem ter algum nível de imunidade à gripe H1N1 e podem explicar porque os sintomas de 2009 relacionados ao H1N1 são geralmente brandos”, disse Carol Cardona, da Escola de Medicina Veterinária da Universidade da Califórnia. O estudo dela foi publicado pela revista Emerging Infectious Diseases” (fonte: site do Terra)
Estou tentando conseguir a íntegra deste artigo, porém ate o momento não tive sucesso. Se vc tiver uma cópia favor enviar.
Levando em consideração as afirmativas, volto a te questionar: Seria a vacinação contra a gripe anual, responsável pela baixa no número de relatos em idosos?
Um grande abraço colega e parabéns.
Att
Paulo Amaral
Oi Paulo,
Bom que você voltou. Não sei se você viu o texto que escrevi em resposta: http://blog.h1n1.influenza.bvsalud.org/pt/2009/09/04/imunidade-previa-e-a-gripe/ Nele eu afirmo que as vacinas sazonais não dão imunidade cruzada, mas os idosos possuem sim imunidade prévia. Caso você não tenha encontrado o artigo, dê uma olhada nas fontes do texto.
Logo depois que escrevi este post, saiu um artigo mostrando que não há proteção por parte das vacinas sazonais, de 2008, 2007, 2006, mas que a vacina de 1976 contra a gripe suína, por causa do ocorrido em Fort Dix, oferece sim proteção. Afinal ela foi produzida contra a linhagem suína. Este é o link do outro post onde comento (por cima) o artigo e aqui vai a referência:
Hancock, K., Veguilla, V., Lu, X., Zhong, W., Butler, E., Sun, H., Liu, F., Dong, L., DeVos, J., Gargiullo, P., Brammer, T., Cox, N., Tumpey, T., & Katz, J. (2009). Cross-Reactive Antibody Responses to the 2009 Pandemic H1N1 Influenza Virus New England Journal of Medicine DOI: 10.1056/nejmoa0906453
a grpe h1n1 tem células?
Ótima pesquisa sobre o mecanismo de ação dos medicamentos, com ótimas e esclarecedoras figura… Parabéns!