27/08/2009
¡Por qué tenemos temor de la gripe 1! – los antivirales
Para empezar la jornada de este blog, y tratar del H1N1 y de la gripe en general, resolví empezar con textos que aborden el otro lado del Influenza. Vamos a ver qué se pasa por detrás del virus y de las decisiones que se toman con relación a él.
![]() Con el virus como el Ébola, que ya llegó a matar más del 90%, ¿por qué tenemos temor el Influenza, que normalmente mata menos que el 0,5% de los infectados? ¿Por qué creemos que las grandes pandemias serán causadas por un virus que puede ni causar síntomas?
Con el virus como el Ébola, que ya llegó a matar más del 90%, ¿por qué tenemos temor el Influenza, que normalmente mata menos que el 0,5% de los infectados? ¿Por qué creemos que las grandes pandemias serán causadas por un virus que puede ni causar síntomas?
Ante todo, tenemos que comprender por que la mayor amenaza puede ser un virus, ya que muchas enfermedades infecciosas graves son causadas por bacterias. Cólera, tuberculosis y otras, muchas de las cuales aún matan millares de personas por año. Y a pesar de nuestros esfuerzos, todavía siguen causando estragos, principalmente en países subdesarrollados. Sin embargo, las bacterias poseen un punto flaco: ellas tienen metabolismo, ellas digieren y producen moléculas.
Virus son parásitos intracelulares obligatorios. Eso significa que necesitan estar dentro de una célula para que puedan reproducirse. Ellos no son capaces de realizar metabolismo, necesitan cooptar aquel de la célula para sí. Ya las bacterias, por más que parasiten otros organismos, poseen un metabolismo propio. Es en esa diferencia que reside el secreto de los antibióticos.
Como somos bien distintos de las bacterias, ellas poseen muchas moléculas distintas que son objetos de antibióticos. La penicilina, por ejemplo, ataca los peptidoglicanos de la pared celular bacteriana. No existe nada parecido en nuestro cuerpo, así la penicilina puede atacar las bacterias sin atingirnos.
Ya en el caso de los virus, la situación es más complicada. Como ellos casi siempre utilizan nuestras moléculas, atacarlas es garantía de graves efectos colaterales. Un problema semejante se presenta cuando intentamos combatir tumores, como son nuestras células creciendo descontroladamente, es muy arduo de atacarlos sin perjudicar células saludables. Nos resta buscar algo de único de los virus y atacar lo que no debe atingirnos. Los primeros objetos son las enzimas.
Enzimas son proteínas que catalizan reacciones químicas. Ellas aceleran reacciones que tardarían mucho tiempo para ocurrir. Para tal, las enzimas necesitan ser capaces de combinarse a lo que van reaccionar, el substrato, y transformarlo en producto. Eso demanda un formato correcto, una estructura que comporte el substrato y favorezca la reacción que ella acelera. Piense en un exprimidor de ajo, que cataliza su transformación en pasta, él necesita tener un diseño correcto y ser capaz de abrigar el diente de ajo para funcionar. Este formato, esta especificidad es lo que utilizamos contra el virus.
Drogas antivirales en su mayoría son capaces de atacar enzimas del virus, utilizando su especificidad. O pasándose por un substrato que no se puede romper y entupe la enzima – un diente de ajo inquebrantable en el ejemplo más arriba – o combinándose a otro punto de la enzima e induciendo un cambio en su formato que acaba con la especificidad – como se estragásemos el eje en el cual el exprimidor se dobla.
En el caso del VIH por ejemplo, uno de los objetos del tratamiento es la proteasa del virus, una enzima que digiere proteínas, con drogas que se combinan y la impiden de funcionar sin atacar nuestras proteasas. Otra clase de drogas son los terminadores de cadena, drogas que se incorporan por las polimerasas virales, enzimas que hacen la copia del material genético, ADN o ARN, impidiéndolas de seguir la copia. Nuestras polimerasas son menos afectadas por estos terminadores porque poseen la actividad de reparo. Cuando incorporan la droga, ellas son capaces de deshacer la reacción y reparar el ADN, al contrario de los virus.
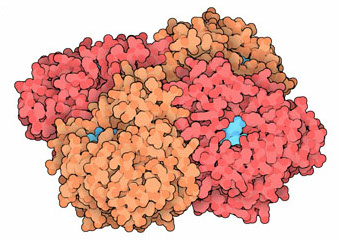
Para el influenza, los antivirales disponibles actualmente se enfocan en dos proteínas. La M2 forma un poro que el virus utiliza para escapar de la vesícula por donde entró en nuestra célula, y el antiviral entupe este poro. La otra proteina es la Neuraminidasa. Esta fragmenta nuestro ácido siálico, un azúcar de la superficie celular que el virus utiliza para entrar y precisa recortar para que pueda salir. Una neuraminidasa con el inhibidor combinado se encuentra en la imagen que ilustra este texto.
La especificidad de las enzimas también es la debilidad de nuestra estrategia de combate. Bacterias son capaces de escapar de antibióticos, generalmente destruyendo la droga o lanzándola para fuera de la célula antes que ella haga efecto. Sin embargo, ambos requieren nuevos pasos en el metabolismo, no tan simples para que sean adquiridos.
Ya para los virus, basta que la enzima pierda la afinidad por la droga. Con algunas mutaciones, el virus es capaz de cambiar su enzima de forma que ella pierda un poco de la especificidad. Ahora, la droga no se combina más como hacía antes. Eso tiene un costo para el virus, casi siempre una enzima resistente a la droga posee una actividad comprometida. Ella se combina con más dificultad al substrato también. Pero una enzima menos eficaz es mejor todavía que una enzima impedida de funcionar, de forma que mismo con un determinado costo, un virus resistente puede ser bien sucedido.
Mientras tanto, buscamos nuevas enzimas objeto, nuevas formas de atacar los virus, que imposibiliten o por lo menos dificulten el surgimiento y propagación de linajes resistentes. Y, principalmente, tenemos que planificar la manera cómo administramos los remedios actuales para que no perdamos los pocos recursos que tenemos. Las vacunas siguen como la mejor medida para prevenir y contener una epidemia de Influenza.
Fuente:
De Clercq, E. (2002). STRATEGIES IN THE DESIGN OF ANTIVIRAL DRUGS Nature Reviews Drug Discovery, 1 (1), 13-25 DOI: 10.1038/nrd703
3 Comentarios » Postado en: lucha contra la gripe


Como em português usou-se a expressão: “tememos/temor” e em inglês: “fear”; creio que, em espanhol, a melhor expressão fosse “tenemos temor/tememos”.
“pavor” em espanhol, como em português, é uma expressão mais forte. Segundo o Diccionario de la lengua española da Real Academia Española:
temor. 1. m. Pasión del ánimo, que hace huir o rehusar aquello que se considera dañoso, arriesgado o peligroso.
3. m. Recelo de un daño futuro.
pavor. 1. m. Temor, con espanto o sobresalto.
—
[]s,
Roberto Takata
Caro Roberto,
Agradecemos o comentário. Voce tem razão, o termo “temor” se aplica melhor, portanto já alteramos o texto em espanhol.
Cordialmente,
Lilian Calò
BIREME/OPAS/OMS
[...] En el texto anterior abordé porque es difícil desarrollar antivirus, aquí vamos a entender cuáles son las características del virus influenza que nos preocupan [...]